Research & Initiatives
본 연구실은 아연을 중심으로 한 신경계의 생리 및 병리적 현상을 규명하고, 이를 통해 질환 발병 기전을 심화 이해하며, 새로운 치료 전략과 치료제 개발을 통해 인류 건강 증진에 기여하고자 합니다.
I. 허혈성 뇌손상 병리 기전 연구 및 선택적 MMP-9 억제제 개발
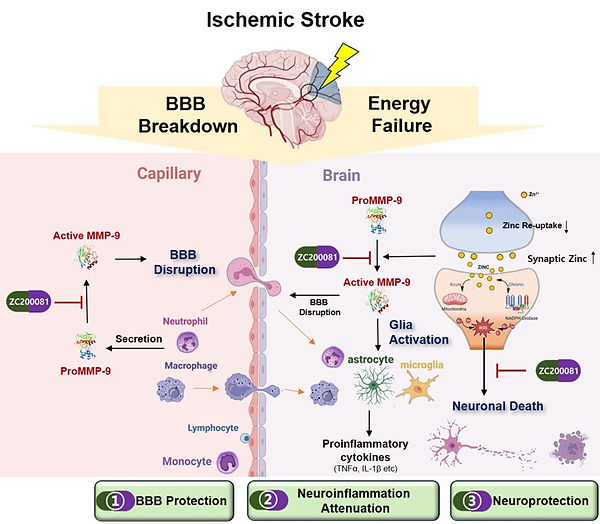
허혈성 뇌손상 (예: 뇌졸중,심정지)에서는 혈액 내 증가된 MMP-9 활성이 혈뇌장벽 (Blood-Brain Barrier)을 붕괴시키고, 뇌 조직의 경우 synaptic cleft에 축적된 아연은 신경독성을 유발합니다이 과정에는 glutamatem astrocyte 및 microglia 활성, 그리고 염증 반응이 복합적으로 작용하며, 아연과 MMP-9이 중심적인 역할을 수행합니다. 본 연구실은 진큐어와 협력하여 MMP-9만을 선택적으로 억제하는 small molecules을 개발하였으며, 이를 기반으로 허혈성 뇌손상 치료제 개발 연구를 수행하고 있습니다.
II. 급성 신경세포 손상에서 아연과 라이소좀의 역할
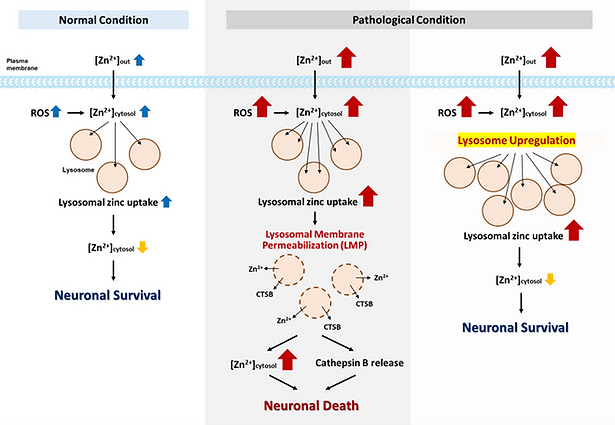
신경세포 내 자유 아연 농도의 급격한 증가는 다양한 경로를 통해 조절되나, 일정 수준을 초과하면 라이소좀 막 붕괴 (Lysosomal Membrane Permeablization, LMP)를 유도하고, 분해효소의 세포질 방출을 통해 세포사를 초래합니다. 본 연구실은 아연-라이소좀 축을 중심으로 신경독성 기전을 규명하고,이를 조절할 수 있는 전략을 탐색하고 있습니다
III. 신경 퇴행성 질환에서 아연과 라이소좀의 역할
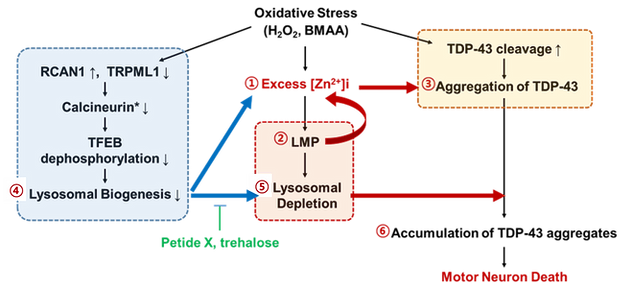
ALS, 알츠하이머병, 파킨슨병과 같은 신경 퇴행성 질환은 단백질 응집체 축적을 특징으로 하며, 산화성 손상 및 노화와 같은 요인이 복합적으로 작용합니다. 본 연구실은 ALS에서 산화성 손상과 아연 증가가 지속적인 LMP를 유도하고, RCAN1 증가로 인한 TFEB 억제를 통해 라이소좀 합성이 감소하며, 이로 인해 TDP-43 축적이 가속화된다는 기전을 제시하고 이를 검증하고 있습니다. G93A-SOD1, A315T-TDP-43 돌연변이, BMAA 등 다양한 모델을 활용한 병인 연구도 병행하고 있습니다.
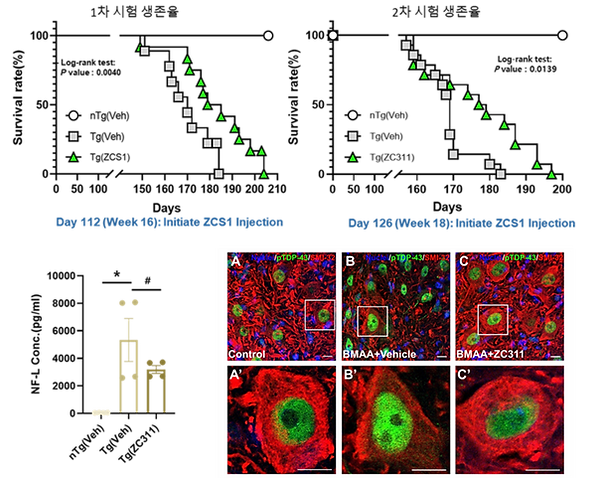
IV. 신경 퇴행성 질환 극복을 위한 라이소좀 활성제 개발
진큐어는 아연 전달을 통해 라이소좀 활성을 유도하는 small peptide ZCS1을 개발하였으며, ALS 모델 (G93A-SOD1 transgenci mice)에서 생존기간 연장, 혈중 Neurofilament light chain (NfL) 감소, TDP-43 축적 억제 등의 치료 효과를 확인하였습니다. 현재 비임상 단계에서 후속 연구를 확장하고 있습니다
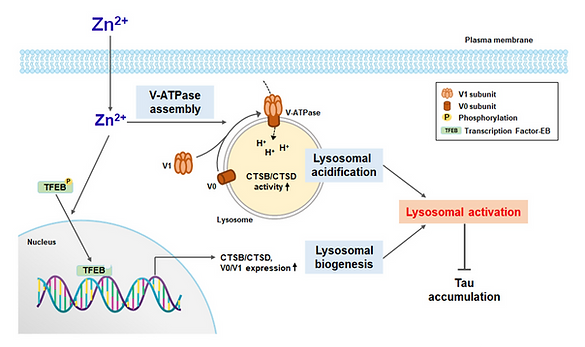
V. 아연에 의한 라이소좀 활성 기전 연구
아주 낮은 수준의 아연 증가만으로도 v-ATPase assembly 촉진을 통해 라이소좀 산성화를 유도하고, TFEB 탈인산화 및 핵 이동을 통해 라이소좀 관련 유전자의 발현을 증가시킬 수 있음을 규명하였습니다.본 연구실은 현재 이와 관련한 세부분자 기전을 규명하고 있습니다.
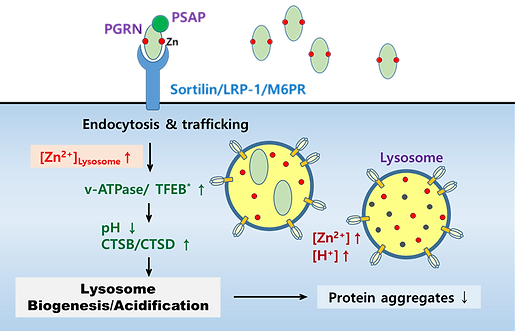
VI. 프로그래뉼린 (Progranulin)에 의한 라이소좀 활성 기전에서 아연 역할
유전자의 결실은 전두측두엽 치매 (FrontoTemporal Dementia, FTD)와 신경 세로이드 리포푸신증 (Neuronal Ceroid Lipofuscinosis, NCL)과 같은 퇴행성 뇌질환을 유발합니다. 프로그래뉼린은 아연과 결합할 수 있는 단백질로 알려져 있으며, 본 연구실에서는 프로그래뉼린이 아연을 라이소좀으로 유입시켜 그 기능을 활성화하는 기전을 규명하고자 연구를 수행 중입니다. 또한, 이러한 기전이 ZCS1의 생리적 작용과 유사할 수 있다는 가정 하에, ZCS1이 프로그래뉼린을 대체하거나 보완할 수 있는 단백질로 작용할 가능성도 함께 탐색하고 있습니다. 이는 ZCS1의 적용 질환 범위를 확장하는데 중요한 기초자료로 활용될 수 있습니다.